歯科衛生士にとって、日々の臨床に関する悩みはつきもの。
「患者さんの口腔内がなかなか改善されない」「患者さんに必要なセルフケアがなかなか身につかない」「話を聞いてくれない」など、臨床現場ではさまざまな悩みが生み出されます。
歯科診療の中でも「予防」に関わることが多い歯科衛生士にとって、歯周病やう蝕予防が思うようにできないケースには頭を抱えさせられるますよね。
この連載では、歯科衛生士が日常的に疑問をもつトピックスについて、その道のエキスパートドクターに徹底解説していただきます!
前回の記事はこちら
今回のお題

レッドコンプレックスといえば、P.gingivalis などの細菌が挙げられますが、実際にそれらが歯周病の発生機序にどう関わっているか、正しく理解できている方は意外に少ないのかもしれません。
今回の疑問にお答えいただくのは、前回に引き続き、アメリカ歯周病学会とヨーロッパインプラント学会の認定医である築山鉄平先生。

歯周病の発症を学ぶ上で、細菌について正しく理解することはとても大切です。
それでは、気になる内容について詳しく解説していただきましょう!
レッドコンプレックスとは?
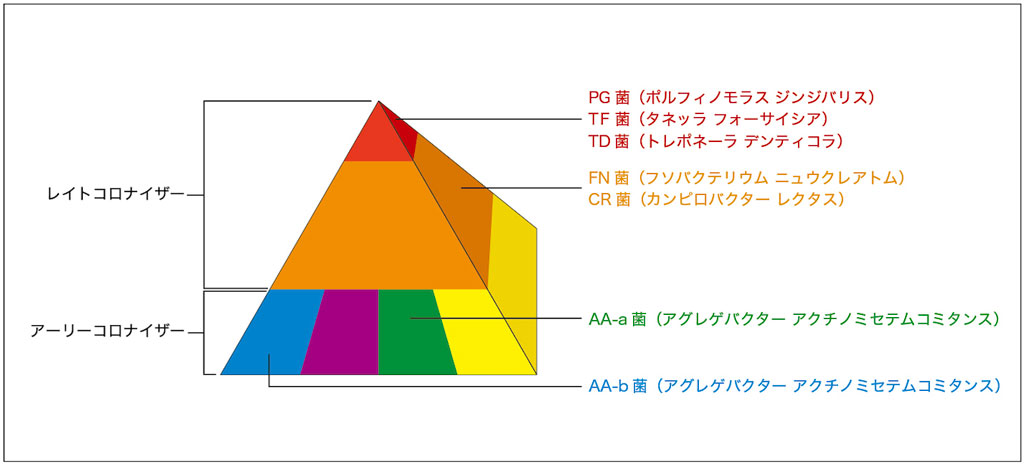
レッドコンプレックスとは、1990年代後半にSocransky先生が提唱したコンセプトである「細菌バイオフィルムピラミッド」*1、*2の頂点に鎮座する、非常に毒性の強い細菌のことを指します。具体的には P.gingivalis や T.forsytia 、T.denticola といった細菌です。
そもそもこのピラミッドは、昨今のコロナ禍で話題になったPCR法にて歯周病原細菌を特定し、その出現するタイミングと毒性により分類したものです(図2-1)。
ブルーやパープルに分類される細菌は初期に出現するため「アーリーコロナイザー」とよばれ、オレンジやレッドはそれらが成熟した後に出現することから「レイトコロナイザー」とよばれます。
ブルーやパープルは平社員、オレンジは中間管理職、レッドは重役のように例えられることがあります。
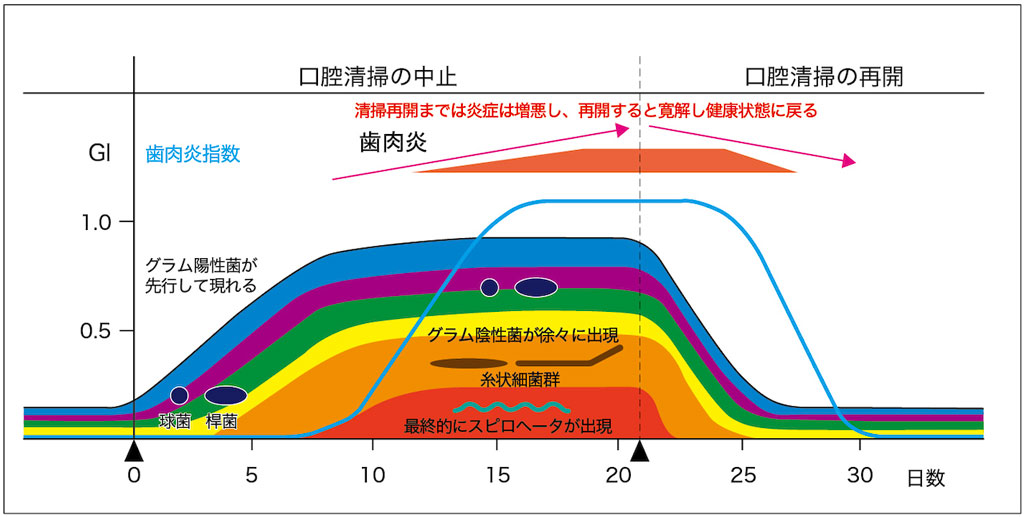
1965年に行われたLoe先生らによる研究*3では、まずブルーやパープルなどのアーリーコロナイザーが出現し、そのあとにオレンジやレッドのレイトコロナイザーが出現してくることが明らかにされました。
また、「レッドコンプレックスが出現してくると歯肉炎が徐々に発症し、ブラッシングにてバイオフィルムを除去すると寛解して健康に戻る」ということも示されました(図2-2)。
この研究などから、第1回で解説したPage先生やKornman先生が提唱した「歯周病の発症機序モデル」*4においても、歯周病原菌が成熟してレッドコンプレックスが多くなると宿主防衛が働きだし、「宿主免疫・炎症反応」が生じると考えられてます(図2-3)。
(参照:臨床の疑問をエキスパートドクターに凸ゲキ質問!「メインテナンスしているのに、なぜ歯周病は再発するの?」)
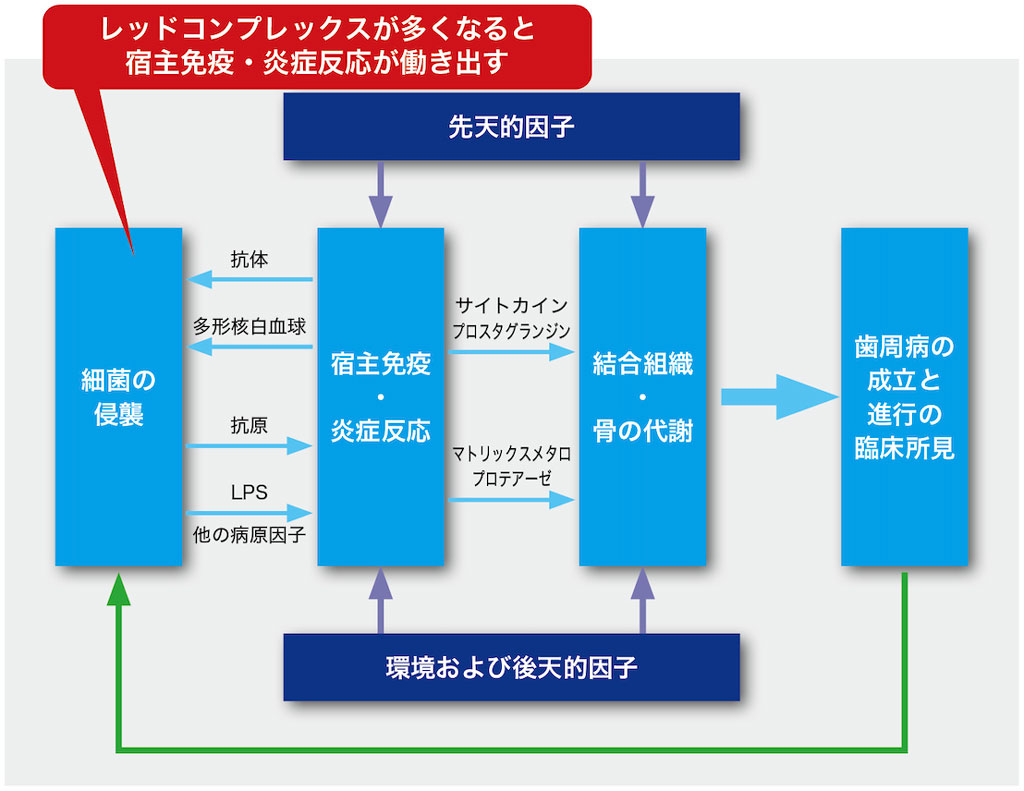
ただ、私たちの口腔内には病的な量では検出できないレベルでもレッドコンプレックスは存在しています。そのため、「存在イコール発症ではない」ということも理解しておきましょう。
それは次のパートでお話しする、新しい仮説にも繋がっています。
最近話題の「ディスバイオシス仮説」でのレッドコンプレックスの位置づけ
ここ数年来「歯周病の新分類」が話題になっていますが、関連する論文や解説書を読んでみると、「ディスバイオシス仮説」*5という言葉が頻繁にでてきます。
これは「歯周病は、細菌叢(細菌の集団)全体のバランスと宿主の反応によって発症する」という、PCR技術の発展に伴い生まれた新しい歯周病の病因論のことです。近年では、歯周病に関わる多くの研究者や臨床家に支持されています。
ディスバイオシス仮説は「疾患の発症には特定の原因菌がある程度関わっているが、それよりも細菌全体のバランスと宿主の反応によって発症にいたるのでは?」という考え方。
歯周病については、以下のように説明されています。
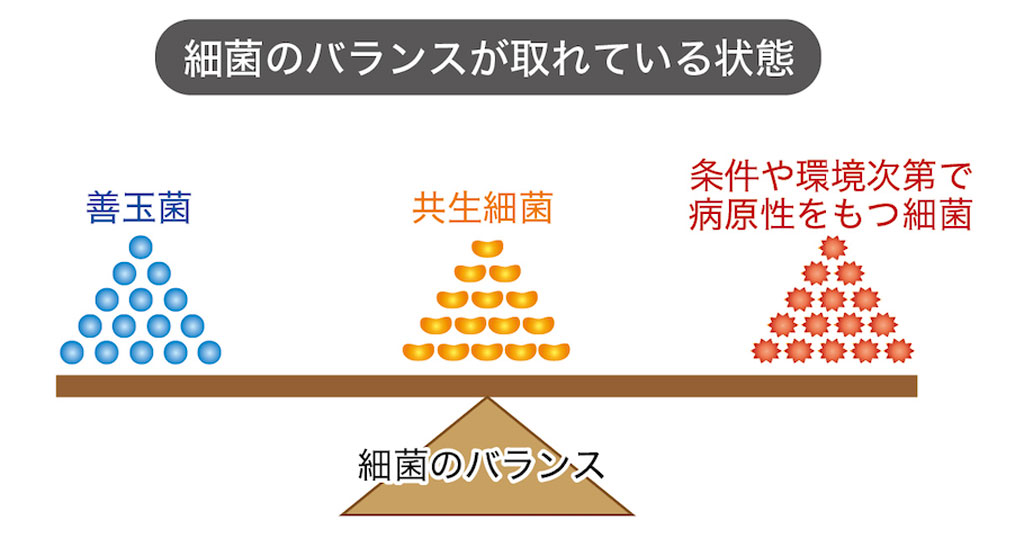
- 口腔内細菌叢の中には、病原性をもたないレベルの歯周病原細菌が存在して、普段は他の細菌と共生関係を保っている
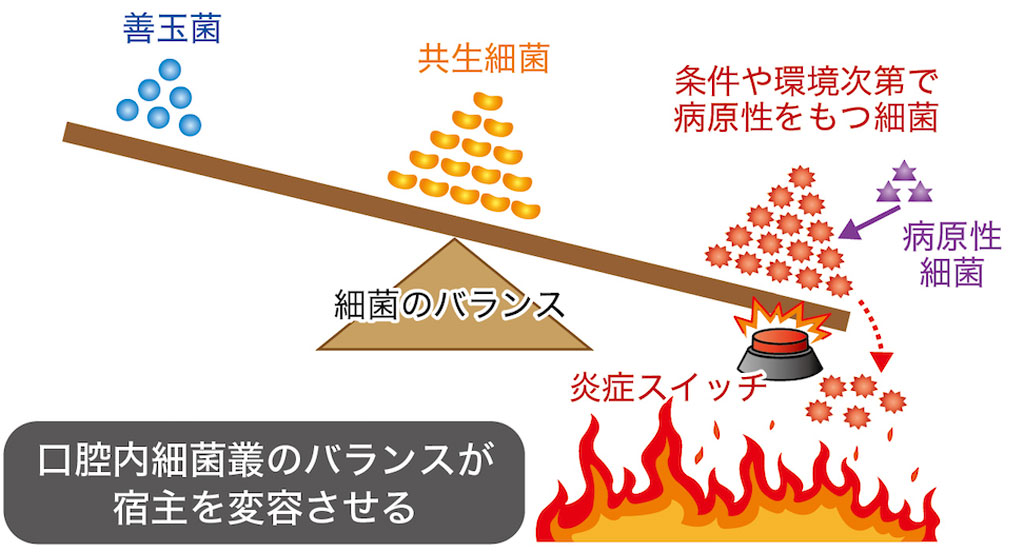
- この共生関係は、ちょっとしたきっかけでそのバランスが崩れ、歯周病原細菌が少しずつ増え炎症のスイッチが押されてしまう

- 炎症環境は歯周病原細胞とっては優位な環境であるため、ますますバランスが悪い方に崩れる。それがある限界を超えた瞬間、宿主にも変化が生じ(歯周病の発症)、いよいよレッドコンプレックスが検査上に検出されるまでになる
レッドコンプレックスは「きっかけ」?それとも「結果」?
ここで注目したいのは、従前の歯周病の発症機序モデルでは、「歯周病原細菌が成熟してレッドコンプレックスが多くなると、宿主免疫・炎症反応が生じる」としているのに対し、ディバイオシス仮説では「炎症環境が進んだ結果として、レッドコンプレックスが検出される」としていることです。
つまり従前の解釈では「レッドコンプレックスは歯周病の原因」の位置づけであるのに対し、ディスバイオシス仮説では「レッドコンプレックスは歯周病の結果」といった位置づけなのです。
ただし我々の臨床的に、プラークを放置して患者さんの炎症や反応を評価することは誤っていると思います。また、量が閾値を超えて増殖したP. gingivalis たちは、それはそれで毒性をもつので、新たな炎症の原因となりうるわけです。
そのため、これまでの通説通り「バイオフィルムの破壊と除去」、そして「患者さんの行動変容」を一貫して行っていくという原則は変わりません。
日常臨床ではどう考えるべき?
ディスバイオシス仮説に則れば、臨床では「炎症のスイッチを入れないような、バランスの取れた口腔内環境を維持すること」がまず大事といえます。
第1回で解説したように、歯周病は宿主の先天的因子や環境・後天的因子に大きく影響を受けることから、歯周病の発症を「レッドコンプレックスの存在」だけにフォーカスを当てて論じてしまうのは不十分*6といえそうです。
また、メインテナンスでは、形成されたバイオフィルムへの対応を主眼としたプロフェッショナルケアを実施することが多いと思います。
しかし一方で、口腔内のバランスを良好な状態に保つための生活習慣やセルフケア習慣の獲得・確認といった「患者教育の場」としてメインテナンスの時間を活用することも重要といえるでしょう。

***
今回は、レッドコンプレックスのことから、新しい歯周病の病因論までを詳しく解説していただきました。
歯科衛生士のみなさんが抱える、日々の臨床での何気ない疑問が解決することを願っています!
聞き手:dstyle編集部
解説:築山鉄平
参考文献:
*1 Socransky SS, Haffajee AD. Dental biofilms: difficult therapeutic targets. Periodontol 2000. 2002;28:12-55.
*2 Socransky SS, Haffajee AD. Periodontal microbial ecology. Periodontol 2000. 2005;38:135-187.
*3 Loe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol. 1965;36:177-187.
*4 Page RC, Kornman KS. The pathogenesis of human periodontitis: an introduction. Periodontol 2000. 1997;14:9-11.
*5 Hajishengallis G, Lamont RJ. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol Oral Microbiol. 2012;27(6):409–419.
*6 Kornman KS. Contemporary approaches for identifying individual risk for periodontitis. Periodontol 2000. 2018;78:12-29.